
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
安徽省淮南市2015届高三一模化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Ca-40
7.氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:
CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
A.HCN分子中既含σ键又含π键B.CaCN2属于共价化合物
C.每消耗10g CaCO3生成2.24L CO2D.CO为氧化产物,H2为还原产物
8.常温下,下列各组微粒在指定溶液中一定能大最共存的是
A.由水电离的c(H+)=1×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
B.pH=1的溶液中:K+、Cr2O72-、SO42-、CH3CHO
C.加石蕊呈蓝色的溶液中:Na+、K+、AlO2-、NO3-
D.0.1mol/LFeCl3溶液中:NH4+、Na+、SCN-、Cl-
9.仅用下表提供的仪器和药品,就能达到相应实验目的是
| 编号 | 仪器 | 药品 | 实验目的 |
| A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量分数的NaCl溶液 |
| B | 分液漏斗、锥形瓶、试管、 导管及橡皮塞 | 浓硝酸、碳酸钠固体、硅酸钠溶液 | 证明酸性:硝酸>碳酸>硅酸 |
| C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 烧杯、分液漏斗、胶头滴管、铁架台 | 混有苯酚杂质的苯、浓溴水 | 提纯混有苯酚杂质的苯 |
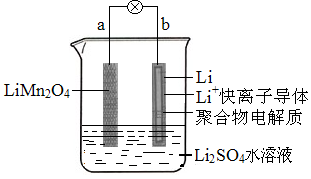 10.2013年3月我国科学家报道了如右图所示的水溶液锂离子电池体系。
10.2013年3月我国科学家报道了如右图所示的水溶液锂离子电池体系。
已知充电时电池总反应为:LiMn2O4=Li1-xMn2O4+xLi,下列叙述正确的是
A.放电时,正极反应为xLi++xe-=xLi
B.放电时,a极锂的化合价不发生变化
C.充电时,b极发生氧化反应
D.充电时,溶液中的Li+从b极向a极迁移
11.一定条件下反应:2A(g)+B(g)![]() 3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横
3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横
坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | A的浓度 | 平衡常数K |
| B | 温度 | 混合气体的密度 |
| C | B的物质的量 | A的转化率 |
| D | 催化剂的质量 | C的体积分数 |
12. 在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论。下列“推理”正确的是
A.lmolO2和Mg完全反应获得4mol电子;则lmo1 O2和其他金属完全反应都获得4mol电子
B.组成和结构相似的物质,沸点随相对分子质量增大而升高,推出SiH4沸点高于CH4
C.加热蒸发食盐水可以得到NaCl(s);则加热蒸发FeCl3溶液可以获得FeCl3(s)
D.苯不能使酸性高锰酸钾褪色,甲苯也不能使酸性高锰酸钾褪色
13. 室温下,下列溶液中粒子浓度关系正确的是
A.0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
B.将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:
c(Na+)=c(A-) +c(Cl-) = 0.2mol/L
C.pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7
D.0.l mol·L-1氯化铵溶液滴加浓盐酸可能有c(NH4+) = c(H+)
25.(16分)Na、Cu、Fe、Cl、O、N是常见的6种元素。
(1)Fe位于元素周期表第_____周期第_____族;O的基态原子核外有______个未成对电子。
Cu的基态原子电子排布式为________。
(2)用“>”或“<”填空:
| 第一电离能 | 原子半径 | 稳定性 |
| N_______O | Cl_______Na | NH3______H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是: 。
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3,写出该反应的离子方程式,并标出电子转移的方向和数目 。
26.(14分)邻羟基桂皮酸(D)是合成香精的重要原料,下列为合成邻羟基桂皮酸的路线之一
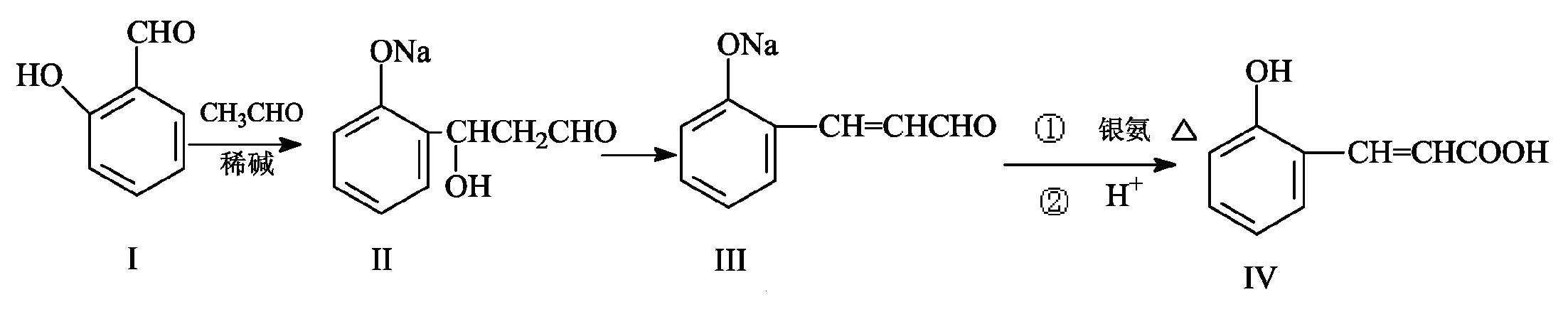
A B C D
试回答:
(1)A中含氧官能团的名称是 和 。
(2)B→C的反应类型 。
(3) D与过量NaOH溶液反应的化学方程式 。
(4)有机物E与D互为同分异构体,且E有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出E的一种结构简式 。
(5)下列说法正确的是 。
c.C可能发生聚合反应d. 1mol有机物D最多能与4mol H2加成
27.(14分)工业上可以利用含铝、铁、铜合金的废料获得的绿矾(FeSO4·7H2O)、胆矾等,甲同学设计的实
验方案如下:
请回答:
(1)操作①、操作②所用的玻璃仪器是 ;沉淀C的化学式为 。
(2)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(3)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(4)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和H2O2制胆矾晶体,则反应④的离子化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L HNO3,欲使3mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
28.(14分)NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式: 。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
| 编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 40 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
表中a= ,b= 。
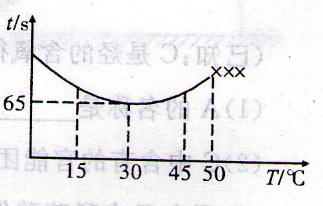 (3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率 mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系: 。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二: ;
………………
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
2015届淮南市高三一模化学答题卷
25.(16分)
(1) 、 ; 。 。
(2)用“>”或“<”填空:
| 第一电离能 | 原子半径 | 稳定性 |
| N_______O | Cl_______Na | NH3______H2O |
(3) 。
(4) 。
26. (14分)
(1) 和 。
(2) 。
(3) 。
(4) 。
(5) 。
27. (14分)
(1) 。 。
(2) 。
(3) 。
(4) ; 。
28. (14分)
(1) 。
(2) , 。
(3)① 。② 。
(4)假设二: 。
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |

