
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
武威市第六中学2018届高三第一轮复习第五次阶段性过关考试
化 学 试 题
1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。考试时间90分钟。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。II卷答案也需答在答题纸上,只答在试卷上不得分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Ca-40
一、选择题(每小题3分,共42分,每小题只有一个选项符合题意)。
1.下列有关物质的性质与用途具有对应关系的是
A.活性炭具有还原性,可用作冰箱除味剂
B.二氧化硫具有氧化性,可用作造纸漂白剂
C.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
D.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
2.下列有关化学用语表示正确的是
A.质量数为31的磷原子:![]() B.氟原子的结构示意图:
B.氟原子的结构示意图:![]()
C.CaCl2的电子式:![]() D.明矾的化学式:Al2(SO4)3
D.明矾的化学式:Al2(SO4)3
3.阿伏加德罗常数的值为![]() ,下列说法正确的是
,下列说法正确的是
A.1 L 0.1 mol·![]() NH4Cl溶液中,
NH4Cl溶液中,![]() 的数量为0.1
的数量为0.1![]()
B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1![]()
C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2![]()
D.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
4.室温下,若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO、Cl-B.K+、Na+、Cl-、NO
C.K+、Na+、Cl-、AlOD.K+、NH、SO、NO
5.下列实验设计及其对应的离子方程式均正确的是
A.用惰性电极电解饱和硫酸铜溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B.Na2O2与H2O反应制备O2:Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性
6.在给定的条件下,下列选项所示的物质间转化均能一步实现的是
A.NaAlO2(aq)![]() Al(OH)3
Al(OH)3![]() Al
Al
B.CaSO4(s)![]() CaCO3(s)
CaCO3(s)![]() (CH3COO)2Ca(aq)
(CH3COO)2Ca(aq)
C.Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D.NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
7. a、b、c、d为原子序数依次增大的短周期主族元素, a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是
A.原子半径:d>c>b>aB.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱D. d单质的氧化性比a单质的氧化性强
8.下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向小苏打溶液中加入硫酸铝溶液 | 有气泡冒出 | 小苏打与硫酸铝发生了反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3∙H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
9.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g)ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1
则x为
A.3a+b-c B.c+3a-b C.a+b-c D.c+a-b
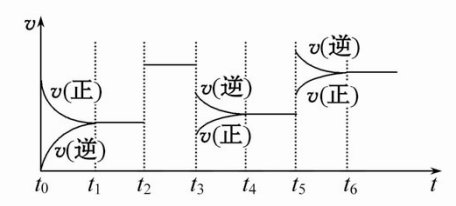 10.某密闭容器中发生如下反应:2X(g)+Y(g) Z(g) ΔH<0。如图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
10.某密闭容器中发生如下反应:2X(g)+Y(g) Z(g) ΔH<0。如图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
A.t3时减小了压强
B.t6时刻后反应物的转化率最低
C.t5时增大了压强
D.t4~t5时该反应的平衡常数大于t6时反应的平衡常数
11.下列图示与对应的叙述不相符合的是
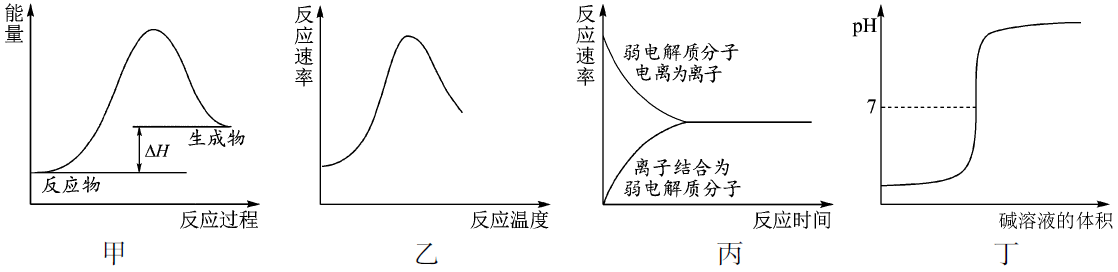
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
12.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是( )
A.电池工作时![]() 向正极极迁移
向正极极迁移
B.正极反应式为2FeO42−+ 10H++6e−===Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
 D. Zn为电池的负极
D. Zn为电池的负极
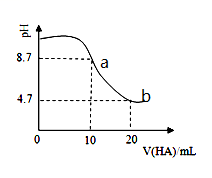
13. 室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)>c(HA)
14.常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH-)
B.pH = 8.3的NaHCO3溶液:c(Na+) >c(HCO3-) >c(CO32-) >c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) >c(OH-) = c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:
2c(H+)-2c(OH-) =c(CH3COO-)-c(CH3COOH)
二、填空题(本题共4小题,共58分)
15.(14分)铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______ .
 (2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为 ,其中氮的化合价为 。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为___ ______,
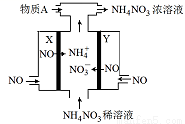
(4)IV中,电解NO制备 NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是__________,说明理由:
。
16.(14分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
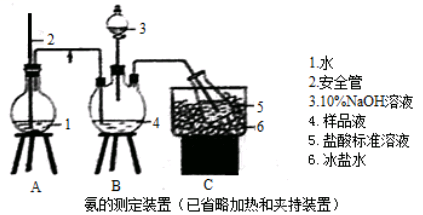
①氨的测定:精确称取W gX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1ml C1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用C2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。回答下列问题:(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
17.(14分)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量碳及二氧化硅)为原料制备的流程如下:
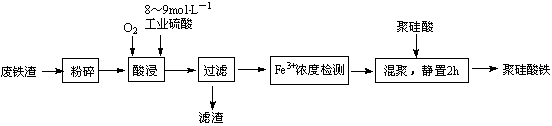
(1)废铁渣进行“粉碎”的目的是____________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如右图所示:
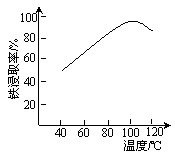
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为___________。
②酸浸时,通入O2的目的是_____________,该反应的离子方程式为_________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是____________。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_______。
18.(16分)汽车尾气中排放的NO和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NO和CO的排放。
已知:①2CO(g)+O2(g) 2CO2(g) ΔH=−566.0 kJ·mol−1
②N2(g)+O2(g) 2NO(g) ΔH=+180.5 k J·mol−1
③2NO(g)+O2(g) 2NO2(g) ΔH=−116.5 k J·mol−1
回答下列问题:
(1)CO的燃烧热为_________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为___________kJ。
(2)CO将NO2还原为单质的热化学方程式为_______。
(3)为了模拟反应2NO(g)+2CO(g) N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.28 | 2.75 | 2.70 | 2.70 |
①前2 s内的平均反应速率v(N2)=___________,此温度下,该反应的平衡常数K=________。
②能说明上述反应达到平衡状态的是_________。
 A.2n(CO2)=n(N2)
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
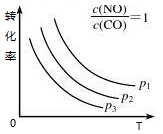
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因是___________ ,图中压强(p1,p2、p3)的大小顺序为_________ 。
参考答案
1-5 D、A、D、B、A
6-10B、B、D、A、C
11-14A、D、D、D
15、1、4Al+3O2=2Al2O3在空气中铝的表面能够形成一层致密的氧化膜
2、NaF水解产生了HF,HF会腐蚀玻璃。
3、![]() +3
+3
10Al+6NO3-+4OH-==3N2+10AlO2-+2H2O
4、NH3,根据反应8NO+7H2O==(电解)4NH4NO3+2HNO3,电解产生的HNO3多
16、1、当A中压力过大时,安全管中液面上升,使A瓶中压力稳定或平衡压强
2、碱 酚酞(或甲基红)
3、![]()
4、偏低
5、防止硝酸银见光分解 2.8×10—3
17、(1)减小颗粒直径,增大浸取时的反应速率和提高铁浸取率(2分)
(2)① Fe3O4+4H2SO4![]() FeSO4+Fe2(SO4)3+4H2O(2分)
FeSO4+Fe2(SO4)3+4H2O(2分)
②将FeSO4氧化为Fe2(SO4)3(2分)
4Fe2++O2+4H+=4Fe3++2H2O
③温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低(2分)
(3)C和SiO2(共2分) (4)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O(2分)
18、 283KJ/mol 631.75
2、2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol
3、 1.875×10-4mol/(L·s) 5000(或5000L/mol)
BD
该反应的正反应放热,升高温度,平衡逆向移动,NO的转化率减小(或正反应放热,温度越高,越不利于反应正向进行,NO的平衡转化率越小) p1>p2>p3