
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
武威六中2017-2018学年度高三一轮复习过关考试(三)
化 学
1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。考试时间90分钟。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。II卷答案也需答在答题纸上,只答在试卷上不得分。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 Al27
C135.5 Fe56 Cu64
第I卷 (选择题 共42分)
一、选择题(每题只有一个选项符合题意,每题3分)
1.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A.这个反应是氧化还原反应 B.制造过程中元素种类没有改变
C.另一种化合物为NaCl D.金刚石属于碳的一种同位素
2.下列对化学知识概括合理的是( )
3.下列物质按纯净物、混合物、电解质、非电解质的顺序正确的一组为( )
A.盐酸、空气、硫酸、干冰 B.蒸馏水、氨水、碳酸氢钠、二氧化硫
C.胆矾、盐酸、铁、碳酸钙 D.生石灰、漂白粉、氯化铜、氧化铝
4.下列说法正确的是( )
A.酸化高锰酸钾溶液时可以用盐酸酸化
B.金属钠着火时不能用泡沫灭火器灭火
C.氢氧化铁胶体的电泳实验,证明了氢氧化铁胶体带电荷
D.能与碱反应生成盐和水的氧化物一定是酸性氧化物
5.下列物质中都是既有离子键又有共价键的一组是( )
A.NaOH、H2O、NH4ClB.KOH、Na2O2、(NH4)2S
C.MgO、CaBr2、NaClD.Na2SO4、HCl、MgCl2
| X | Y | ||
| W | Z | ||
| T |
6.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
7.下列说法不正确的是( )
A.标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移电子总数为0.1mol
B.海水提镁和海水提溴都涉及氧化还原反应
C.向Na2CO3溶液中滴加盐酸溶液,一定有CO2气体生成
D.Na2O2常用于潜水艇或呼吸面具的供氧剂
8.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数为0.4 NA
D.常温下56 g铁片投入足量浓H2SO4中生成NA个SO2分子
9.下列离子在指定条件下能大量共存的是( )
A.c(I-)=0.1 mol/L的溶液中:Ca2+、NO3-、Fe3+、Cl-
B.SO2饱和溶液中:NH4+、K+、CO32-、ClO-
C.放入镁带有气体逸出的溶液中:Na+、K+、Cl-、SO42-
D.常温下水电离出c(H+)=1×10-10 mol/L的溶液中:NH4+、Na+、S2-、CH3COO-
10. a、b、c、d为原子序数依次增大的短周期主族元素, a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
11.向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
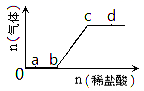 A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
C.b点对应的溶液中:Al3+、Fe3+,MnO4-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
12.下列反应的离子方程式不正确的是( )
A.物质的量相等的溴化亚铁跟氯气反应:2Fe2++ 2Br-+ 2Cl2=2Fe3++Br2+4Cl-
B.Ca(HCO3)2溶液中加入足量NaOH:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全:2A13++3SO42-+3Ba2++6OH-===2A1(OH)3
↓+3BaSO4↓
D.向碳酸钠溶液中滴加过量的稀硫酸: CO32-+2H+=CO2↑+H2O
13.下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
| Ⅰ | Ⅱ | ||
| A | 将少量SO2通入Ba(OH)2溶液 | 将过量SO2通入少量Ba(OH)2溶液 | |
| B | 将少量NaHSO4溶液滴入Na2CO3溶液 | 将少量Na2CO3溶液滴入NaHSO4溶液 | |
| C | 将0.1mol Cl2通入含0.2molFeBr2的溶液 | 将0.3mol Cl2通入含0.2mol FeBr2的溶液 | |
| D | 将浓氨水滴入Al2(SO4)3溶液 | 将Al2(SO4)3溶液滴入浓氨水 | |
14. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
第II卷 (非选择题 共58分)
15.(14分)某研究性学习小组计划研究当地酸雨的形成过程,于是取来雨水作水样进行测定,随时间的推移,多次测定该样品的pH,得到如下数据:
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
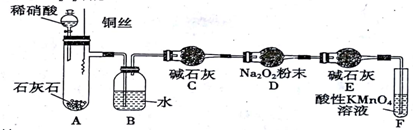
16.(16分)某研究性学习小组的同学为了探究NO的性质,进行了如下实验。
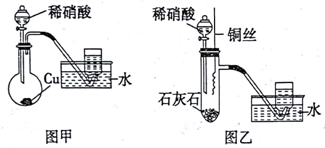
査阅资料:
a.2NO+ Na2O2=2NaNO2;
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O;
c.酸性条件下,NO能被MnO4-氧化生成NO3-。
丙同学在乙同学的实验基础上,用下图所示装置探究NO与Na2O2的反应。
① C装置中碱石灰的作用是___________ ; F装置中反应的离子方程式为_________ 。
②充分反应后,检验D装置中是否发生反应2NO+Na2O2=2NaNO2的实验操作是_________ 。
17. (14 分)(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式为 。向反应后的溶液中通入过量CO2,反应的离子方程式为 。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
,又变为棕黄色的原因是(用离子方程式解释)
。
(3) 取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,则消耗 KMnO4的物质的量是 mol。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式
,
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是
18. (14分)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
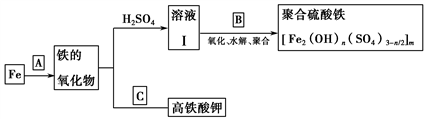
请回答下列问题:
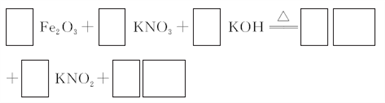
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O===2I-+S4O![]() 。
。
①出滴定选用的指示剂 ,滴定终点观察到的现象
。
②溶液Ⅰ中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高”“偏低”或“不变”)。
武威六中2017-2018学年度高三一轮复习过关考试(三)
化 学 答 案
1-14:DCBBB; DCBCB; BCDA
15.(14 分) (1)2H2SO3+O2===2H2SO4 2分
雨水溶解二氧化硫生成亚硫酸,亚硫酸又被空气中的氧气氧化为硫酸,降落下来形成酸雨 2分
减小 2分
自来水中的氯气(或次氯酸)把亚硫酸氧化成硫酸 2分
还原 2分
(2).C 2分
(3).C 2分
16.(16分)
②取D装置中固体少许于试管中,加入稀硫酸,若产生无色气体,且遇到空气变红棕色,
则2NO+Na2O2=2NaNO2发生,若气体不变色,则该反应未发生(答案合理即可) 2分
17.(14分) (1) NaAlO2- 2分 化学方程式(略) 2分
(2) 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+2分
3Fe2++4H++NO3- =3 Fe3++NO+H2O 2分
(3) 0.032mol 2分
(4) 3NF3+5H2O=9HF+2NO+HNO32分
产生红棕色气体 2分
18(14分)(1)略 2分
(2) 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 2分
(3)1+3+4=2K2FeO4+3+2H2O 2分
(4)淀粉 2分
滴加最后一滴标准液溶液蓝色消失且半分钟不恢复 2分
5.6 2分
偏高 2分