
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
庄浪四中2015-2016学年高三第一次模拟考试题
高 三 化 学
原子量;H―1 C―12 O―16 Na―23 Mg―24 C1―35.5 K―39 Ca―40 N―14 Cu―64
一 选择题
1“物质的量”是联系宏观世界和微观世界的桥梁。下列说法正确的是( )
A.“摩尔”是“物质的量”的单位
B.1 mol O2的质量是32 g/mol
C.任何气体的“气体摩尔体积”均为22.4 L/mol
D.10 mL 2 mol/L H2SO4溶液中取出的5 mL溶液,其浓度为1 mol/L
2.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO)=0.8 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1C.0.3 mol·L-1 D.0.4 mol·L-1
3.下列实验操作或记录正确的是( )
A.常温常压下测得1 mol N2的质量为28 g
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.用两只250 mL的容量瓶配制0.1 mol·L-1500 mL的NaOH溶液
D.用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
4.NA代表阿伏加德罗常数,下列说法正确的是( )
A.同温同压下,相同体积的任何气体单质所含的原子数相同
B.1 mol过氧化钠中阴离子所带的负电荷数为2NA
C.常温常压下,11.2 L氮气所含的原子数目为NA
D.某温度时,pH=6的纯水中,含10-6NA个OH-
5.标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为( )
C. mol/L D. mol/L
6.下列有关实验的叙述中正确的是( )
A.用烧杯或烧瓶给液体物质加热时,没有垫石棉网
B.酒精和浓硫酸混合共热至170 ℃,可制得乙稀
C.用托盘天平称量固体药品时,药品放在右盘上
D.如果未知溶液中滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定含有硫酸根离子
7.下列实验中,所采取的分离方法与对应原理都正确的是 ( )
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离氢氧化铁胶体和氯离子 | 盐析 | 胶体不能透过半透膜,离子能 |
| B. | 分离植物油和水的混合物 | 分液 | 二者互不相溶且沸点不同 |
| C. | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D. | 除去乙醇中的乙酸 | 蒸馏 | 乙醇与乙酸沸点相差较大 |
8. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在pH=1的溶液中:K+、Na+、SO42–、HCO3-
B.在0.1 mol·L-1Na2CO3溶液中:Al3+、K+、NO3-、SO42–
C.在0.1 mol·L-1FeCl3溶液中:K+、NH4+、I-、SCN-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
9. 右图是研究铁钉腐蚀的装置图,下列说法不正确的是( )
A.铁钉在两处的腐蚀速率:a< b
B. a、b两处铁钉中碳均正极
C. a、b两处铁钉中的铁均失电子被氧化
D. a、b两处的正极反应式均为O2+4e-+4H+===2H2O
10.2014年1月我国大部分地区被雾霾笼罩,1月12日北京PM2.5指数濒临“爆表”,空气质量持续六级严重污染.PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小颗粒物,也称为可入肺颗粒物.下列有关说法中错误的是( )
A.大雾的形成与汽车的尾气排放有一定的关系
B.微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体
C.实施绿化工程,可以有效地防治PM2.5污染
D.PM2.5表面积大,能吸附大量的有毒、有害物质
11.在下列实验操作中均用到的仪器是 ( )
①配制一定物质的量浓度的溶液;②用pH试纸检验溶液酸碱度;
③过滤;④蒸发
A.试管 B.漏斗
C.胶头滴管 D.玻璃棒
12.石油裂化的主要目的是为了( )
A.提高轻质液体燃料的产量 B.便于分馏
C.获得短链不饱和气态烃 D.提高汽油的质量
13.下列关于工业生产的说法中正确的是( )
A.氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应
B.硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成
C.电解精炼铜时,纯铜作为阳极,粗铜作为阴极
D.工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率
14.生产、生活离不开各种化学物质,下列说法不正确的是( )
A.不需要通过化学反应就能从海水中获得淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用硅制造光导纤维
15.下列事故处理不正确的是( )
A 不慎把浓硫酸沾在手上,立即用干布拭去,再用水冲洗
B. 不慎把苯酚沾在手上,立即用70℃以上的热水冲洗
C. 金属钠着火,用泡沫灭火机扑灭
D. 酒精灯不慎碰翻着火,用湿布盖灭
16.下列保存物质的方法正确的是( )
A. 把汽油放在带橡皮塞的玻璃瓶中 B 把氢氟酸放在玻璃瓶中
C 把少量白磷贮存在冷水中 D. 把水玻璃贮存在带玻璃塞的玻璃瓶中
17.与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
A.提高了原料的原子利用率
B.降低了生产成本
C.减少了环境污染
D.减轻了对设备的腐蚀
18.下列有关使用托盘天平的叙述,不正确的是( )
A.称量前先调节托盘天平的零点;称量时左盘放被称量物,右盘放砝码
B.潮温的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其它固体药品可直接放在天平托盘上称量
C.用托盘天平可以准确称量至0.1g
D.称量完毕后,应把砝码放加砝码盒中
19.下列说法不正确的是( )
A. 标准状况下,22.4L·mol-1就是气体摩尔体积
B. 非标准状况下,1mol任何气体的体积不可能为22.4L
C. 标准状况下22.4L任何气体都含有约6.02X1023个分子
D. 1molH2和O2的混合气体在标准状况下的体积约为22.4L
20.阿伏加德罗常数为6.02×1023mol-1,下列叙述正确的是( )
A.4 g重水(D2O)中所含中子数为0.2×6.02×1023
B.32 g含有少量臭氧的氧气中,共含有氧原子1.204×1024
C.4.48 L H2和O2的混合气体中所含分子数为0.2×6.02×1023
D.0.1 mol Na2O2溶解于足量的水中,转移电子数为0.2×6.02×1023
21.设NA代表阿佛加德罗常数的值,下列说法错误的是( )
A.12g C60中含有6NA个电子
B. 1mol HNO3见光分解,转移电子数NA
C. 46g NO2和 N2O4混合物含有的原子数为3NA
D. 常温下,60g SiO2中含有NA个Si-O键
22.1mol 氯气与足量水反应,转移电子为( )
A.2mol B. 1mol
C.3mol D.4mol
23、用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA
B.常温常压下1 mol NO2气体与水反应生成NA个NO3-离子
C.0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA
D.80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA
24.在标准状况下, m g气体A与n g气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m∶n
B.同质量的气体A与B的分子个数比为n∶m
C.同温同压下,A气体与B气体的密度比为n∶m
D.同温同压下,同体积的A气体与B气体的质量比为m∶n
25.在一定的温度、压强下,向100 mL CH4和Ar的混合气体中通入400 mL O2,点燃使其完全反应,最后在相同条件下得到干燥气体460 mL,则反应前混合气体中CH4和Ar的物质的量之比为( )
A.1∶4 B.1∶3
C.1∶2 D.1∶1
二 非选择题
26.(18分)氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空:
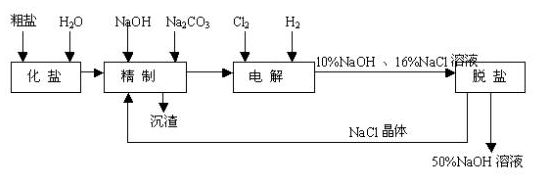
(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
___________________________________ ____________________________________
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________。(选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却、________(填写操作名称)除去NaCl。
(6)在电解过程中,发生总反应的化学方程式为__________________________
(7)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,请写出
Cl2和NaOH溶液反应的化学方程式________________________。
27.(10分)实验需要0.1mol/L NaOH溶液450mL,根据溶液配制中的情况回答下列问题:实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用托盘天平称取______ g氢氧化钠固体;
②加水溶解,冷却后将溶液沿玻璃棒注入______;
③用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中;
④继续向容量瓶中加蒸馏水,直到液面接近刻度线______ cm处;
⑤改用______ 逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
⑥盖好容量瓶塞,反复颠倒,摇匀;
⑦将配好的溶液倒入试剂瓶中,贴好标签.
(2)配制过程中,下列情况会使配制结果偏高的是______(填序号)
①定容时俯视刻度线观察液面; ②容量瓶使用时未干燥;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;
④移液后未洗涤烧杯和玻璃棒.
28(8分).目前,我国采用“接触法”制硫酸,设备如图所示:
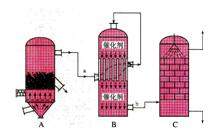
(1)图中设备A的名称是__________________,该设备中主要反应的化学方程式为____________________________________________________。
(2)有关接触法制硫酸的下列说法中,不正确的是_________________________________
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C. B装置中反应的条件之一为较高温度是为了提高SO2的转化率
D.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
(3) 用18 mol/L 的浓硫酸配制100 mL 3.6 mol/L 稀硫酸,所需浓硫酸的体积是
29. (8分)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:________________________________________________________________________;
(2)写出“联合制碱法”有关反应的化学方程式:
________________________________; _______________________________。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2来源于______________,“氨碱法”中CO2来源于______________________________________。
30(6分)下图为实验室制取蒸馏水的实验装置图
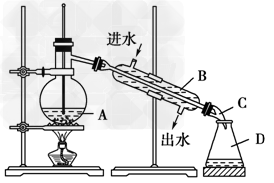
请根据图示回答下列问题:
(1)指出图中两处 明显的错误:①_____________________,②_____________________。
(2)仪器A、B、C的名称分别是____________、____________
(3)实验时,A中除加入少量自来水外还需要加入少量_________,
其作用是____________________________________。
