
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
![]()

可能用到的相对原子质量:Li-7 C-12 N-14 O-16 Ca-40 Ti-48 Al-27
第I卷
一、选择题(共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一个选项符合题目要求)
7、化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是
A.暖贴中常有活性炭、氯化钠、水和还原铁粉等,使用时炭和铁粉发生反应放出热量
B.糖类、油脂和蛋白质是人体必需的营养物质,故纤维素也能为人体提供营养
C.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
D.《本草纲目》中“凡酸坏之酒,皆可蒸烧”所用的分离操作方法是蒸馏
8、下列说法正确的是(NA表示阿伏伽德罗常数)
A.地下钢铁管道用导线连接锡块可以减缓管道的腐蚀
B.1molCl2 溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
C.反应TiO2(s)+2Cl2(g)=TiCl4(g) △H>0 能自发进行,其原因是△S>0
D.常温下Ksp[Mg(OH)2]=5.6×10-2,则pH=10 含Mg2+的溶液中,c(Mg2+)<5.6×10-8 mol/L
9、已知![]() (a)、
(a)、![]() (b)的分子式均为C8H8,下列说法正确的是
(b)的分子式均为C8H8,下列说法正确的是
A.a、b 的一氯代物分别有5 种和3 种(不考虑立体异构)
B.a、b 中所有原子均可能处于同一平面
C.a、b 均可使溴的四氯化碳溶液褪色
D.a 的同分异构体只有b一种
10、下列实验的现象及结论均正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeCl2溶液中加入适量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2 部分变质 |
| B | 向NaBr溶液中滴入少量氯水和苯,振荡,静置 | 分层,上层呈橙红色 | Br- 还原性强于Cl- |
| C | 将SO2通入BaCl2溶液中,然后滴入稀硝酸 | 产生白色沉淀且沉淀不溶于稀硝酸 | 白色沉淀为BaSO3, 然后转化为BaSO4 |
| D | 将稀硫酸滴入淀粉溶液中并加热, 冷却后再加入新制Cu(OH)2悬浊液并加热 | 未出现砖红色沉淀 | 淀粉未水解 |
11、短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne 具有相同的电子层结构,X的族序数等于周期数,Y 与Z最外层电子数之和为10。下列说法不正确的是
A.X 的最高价氧化物的水化物能溶解在Z 的最高价氧化物的水化物溶液中
B.W、X、Z 的简单离子均能促进水的电离
C.W 的氢化物与X、Y、Z 的氧化物均不反应
D.原子半径:X>Y>Z>W
12、铝石墨双离子电池是一种全新的低成本高效电池。原理为:AlLi+Cx(PF6)![]() Al+xC+Li++PF6-,电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-,电池结构如图所示。下列说法正确的是
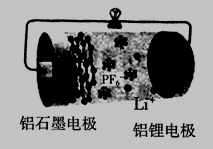
A.放电时外电路中电子向铝锂电极移动 B.放电时正极反应为Cx( PF6)+e-= xC+ PF6-
C.充电时,应将铝石墨电极与电源负极相连
D.充电时,若电路中转移1mol 电子,阴极质量增加9g
13、25℃时,将1.0 L.w mol/LCH3COOH 溶液与0.1mol NaOH 固体混合,充分反应。然后向混合液中加入CH3COOH 或CH3COONa 固体(忽略体积和温度变化),溶液pH 的变化如图所示。下列叙述正确的是
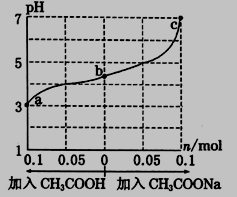
A.b点混合液中c( Na+)>c(CH3COO-)
B.加入CH3COOH 过程中,[c(Na+)·c(OH-)]/ c(CH3COO-)增大
C.c点存在:c( CH3COOH )+c(CH3COO-)=0.1+w
D.a、b、c 对应的混合液中,水的电离程度由大到小的顺序是c>a>b
26、(15 分)二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿( 主要含CeCO3F)为原料制备CeO2 的一种工艺流程如下:

已知:i.Ce4+能与F-结合成[ CeFx](4-x)+,也能与SO42-结合成[CeSOa4]2+;
ii.在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能
iii.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol/L。请回答下列问题:
27、(14 分)乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷)![]() CH4(g)+C3H6(g)
CH4(g)+C3H6(g)
请回答下列问题
| 物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
| 生成热/ kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①0~10min 内乙烷的生成速率v(C2H6)=__________ mol·L-1·min-1
②上述条件下,正丁烷的平衡转化率为______________,该反应的平衡常数K 为____________。 (5) 丁烷一空气燃料电池以熔融的K2CO3( 其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-=26CO32-,则负极反应式为_______________________。
28、( 14 分)某学生对Na2SO3 与AgNO3在不同pH下的反应进行探究,过程如下:
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
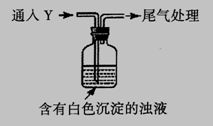
①气体Y 是__________________。
②白色沉淀转化为X 的化学方程式是__________________________。
(二)选考题:共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做第一题计分。
35、[化学一选修3:物质结构与性质]( 15 分)
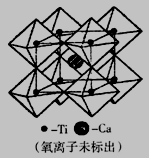
钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。
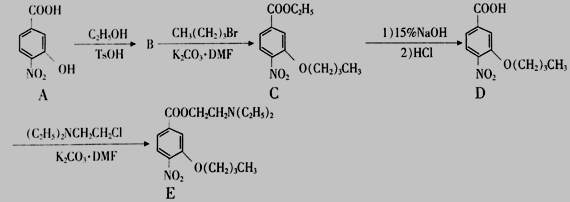
36、[化学一选修5:有机化学基础]( 15 分)
化合物E 是合成一种眼科表面麻醉用药的中间体,其合成路线如下:

一、选择题,共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一个选项符合题目要求。
7-13:DCABCBC
26、(15分)(1)第六周期 III B族(1分)
(2)矿石粉碎成细小颗粒、通入大量空气 (2分,其它合理答案均给分)
(3)CeO2+4H++SO42-![]() [CeSO4]2++H2O (2分) 增大c(SO42-),以提高[CeSO4]2+的浸出率 (2分其它合理答案均给分)
[CeSO4]2++H2O (2分) 增大c(SO42-),以提高[CeSO4]2+的浸出率 (2分其它合理答案均给分)
(4) [CeSO4]2+、Ce4+ (2分)
(5)2Ce4+ +H2O2=2Ce3++O2 ↑+2H+ (2 分) 1×10-6mol/L (2分) (6)2xCO+CeO2=CeOx(1-x)+2xCO2 (2分)
27、(14 分)(1) C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g)△H =+92kJ·mol-1 (2 分)
C2H4(g)+C2H6(g)△H =+92kJ·mol-1 (2 分)
(2)BD(2分) 升高温度 (1分) (3)催化剂活性降低,副产物增多 (2分)
(4)①0.015(2 分) ②75%(1分) 0.45(2分) (5)C4H10+13CO32--26e-=17CO2+5H2O (2分)
28、(14分)(1)①2Ag++SO32-=Ag2SO3↓(2分) ②SO32-有还原性,若被氧化为SO42-,即可与Ag+结合生成Ag2SO4沉淀 (2分) (2)过量Na2SO3(1分) (3)①判断 X 是 否 是 Ag2O (2分)
②有还原性,含有Ag元素,不含S元素(2分) ③Ag+2HNO3(浓)=AgNO3+NO2↑+H2O (2分)
(4)①SO2 (1 分) ②Ag2SO3+ H2O![]() 2Ag + H2SO4 (2分)
2Ag + H2SO4 (2分)
35、(15 分)(1)![]() 5(每个1分,共2分)
5(每个1分,共2分)
(2)当激发态金属原子的电子由高能级跃迁至低能级时,多余能量以光的形式释放就产生了焰色。(2分)
(3)FeCl3是分子晶体,熔沸点决定于分子间作用力;CaCl2是离子晶体,熔佛点决定于晶格能。分子间作用力远远小于晶格能 (2分) (4)极性(1分) П43(2分)
(5)6(1分) 12(1分) CaTiO3(2 分) 136/( a3·NA·10-30) (2分)
36、(15分)(1)酯基 醚键 (每个1分,共2分) (2)取代反应(1分)
(3)![]() (2分) 保护羧基(2分)
(2分) 保护羧基(2分)
(4)8(2分)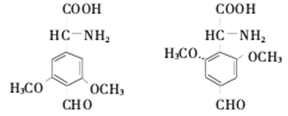 (每个1分,共2分)
(每个1分,共2分)
(5) 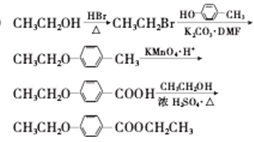 (每步1分,共4分)
(每步1分,共4分)
欢迎访问“”——