
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
辽源市第五中学2017-2018学年度高三第一次摸底考试
化学试卷
原子量:O 16 Na 23 CL 35.5 C 12 K 39 Ba 137 S 32
一、选择题(每小题2分,满分50分)
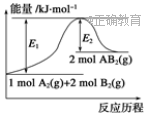 1.已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
1.已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
2.下列有关说法正确的是( )
A.因为合金在潮湿的空气中易形成原电池,所以合金的耐腐蚀性都较差
B. 25℃时,pH=4.5的硫酸溶液中c(H+)是pH=5.5的磷酸中c(H+)的10倍
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D. 常温下,2NO(g)+O2(g)![]() 2NO2(g)能够自发进行,则该反应的△H>0
2NO2(g)能够自发进行,则该反应的△H>0
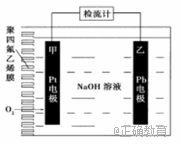 3.手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准状况),某电极增重了bg。下列说法正确的是( )
3.手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准状况),某电极增重了bg。下列说法正确的是( )
4.从下列实验事实所得出的相应结论不正确的是( )
| 选项 | 实验事实 | 结论 |
| A | Na2S2O3溶液与稀硫酸反应,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生变化 | 催化剂一定不参与化学反应 |
| C | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌反应 | 二者速率相同 |
| D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正逆反应速率均加快 |
5.用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是()
6.甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是( )
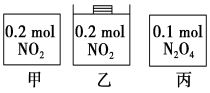 平衡时各容器内c(NO2)的大小顺序为乙>甲=丙
平衡时各容器内c(NO2)的大小顺序为乙>甲=丙7.常温下,电解质溶液中的下列关系式不正确的是( )
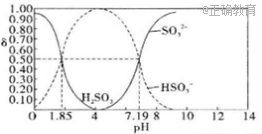 8.25℃时,向100mL 1mol.L-1H2SO3溶液中逐滴加入1mol/L的NaOH溶液,溶液中含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示。下列说法不正确的是( )
8.25℃时,向100mL 1mol.L-1H2SO3溶液中逐滴加入1mol/L的NaOH溶液,溶液中含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示。下列说法不正确的是( )
9.下列有关电解质溶液的说法正确的是( )
10.下列离子在稳定人体血液的pH中起作用的是( )
A.Fe2+ B. Na+ C. HCO3- D. Cl-
11.下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是( )
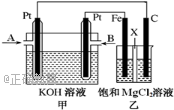 甲中B处通入CH4,电极反应式为CH4+10OH--8e-===CO32-+7H2O
甲中B处通入CH4,电极反应式为CH4+10OH--8e-===CO32-+7H2O12.以下事实不能说明醋酸是弱酸的是( )
13.下列说法正确的是()
14.反应NH4HS(s)![]() NH3+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )
NH3+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )
①温度、容积不变时,通入SO2气体②移走一部分NH4HS固体
③容积不变,充入氮气④充入氮气,保持压强不变
15.下列化学实验事实及解释不正确的是()
16.下列说法正确的是( )
17.下列离子方程式书写正确的是( )
18.将一定量的CO2气体通入NaOH溶液中,将产物在一定条件下蒸干后有三种可能:全部是Na2CO3,全部是NaHCO3,可能是Na2CO3与NaHCO3的混合物。现在取蒸干后的固体物质27.4g,发现如果在空气中加热片刻后称量重将变成25g ,如果将固体溶于200 mL、2mol/L的稀盐酸中发现恰好完全反应,并完全放出二氧化碳气体。那么将与盐酸反应后的溶液蒸干、灼烧称量,其质量为()
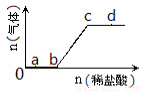 19.向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
19.向Na2CO3、NaHCO3的混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
20.下列各组物质,无论前者是否过量,都能用同一离子方程式表示的是( )
C. 碳酸氢钠溶液,澄淸石灰水 D. 氯水,溴化亚铁溶液
21.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
22.下列有关铝及其化合物的叙述正确的是( )
23.化学是一门实用性很强的科学,与社会、环境等密切相关。下列说法错误的是( )
24.向以下六种饱和溶液中分别持续通入CO2,最终得到沉淀或析出晶体的一组是( )
①Na2CO3②Ca(OH)2③Na2SiO3④NaA1O2⑤Ba(NO3)2⑥ NH3和NaCl
 ①③④⑥ B. ②③④⑥ C. ③④⑤⑥ D. ①②③⑤
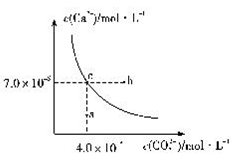
①③④⑥ B. ②③④⑥ C. ③④⑤⑥ D. ①②③⑤25.在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。下列说法正确的是( )
二、填空题(满分50分)
26.(10分)
(1)下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l) E.NaHSO4(s) F.石墨(s) G.蔗糖(s) H.NaOH(l)
属于非电解质的是_________,属于强电解质的是_________,能直接导电的是____________________,能溶于水,且水溶液能导电的是________________。
(2)将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为______,经测定溶液中含CH3COO-的浓度为1.4×10-3mol/L,此温度下醋酸的电离常数:Ka=____________,温度升高Ka将____________(填“变大”、“不变”或“变小”)。
(3)Al(OH)3的电离方程式可表示为:________________________________。
a、向Al(OH)3沉淀中加入盐酸,沉淀溶解,有关的离子方程式为________________________________。
b、向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,有关的离子方程式为__________________________。
27.(8分).
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质,具体实验流程如下:
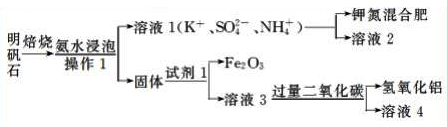
请回答下列问题:
(2)写出上图“固体”中所有氧化物的化学式____________。
(3)由溶液3制取氢氧化铝的离子方程式为______________。
(4)请你写出验证溶液l中有K+的实验操作:_______________。
(5)为测定混合肥料K2S04、(NH4)2SO4中钾的含量,完成下列步骤:
①称取钾氮肥试样并溶于水,加入足量___________溶液,产生白色沉淀。
②过滤、洗涤、干燥。其中,检验沉淀是否洗涤干净的操作方法为______________________。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为nmol, 则试样中K2S04的质量分数为:____________(用含m 、n 的代数式表示)。
28. (8分)
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O2(g)=2CO(g) △H=―221kJ·molˉl若某反应的平衡常数表达式为:![]() ,请写出此反应的热化学方程式______________________________。
,请写出此反应的热化学方程式______________________________。
(2)氨的催化氧化是硝酸工业中最重要的一个反应:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ·mol-1;
4NO(g)+6H2O(g) △H=-905kJ·mol-1;
一定温度下,向2L某恒容密闭容器充入一定量的NH3、O2,测得NO与某种物质a的浓度与时间的关系如图1所示。
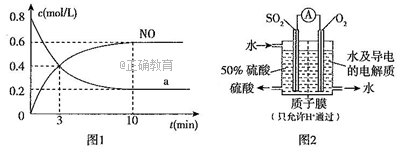
①物质a是___________,前3 min内用O2表示的平均反应速率v(O2)=____________(保留小数点后两位)。
②若最初通入的O2物质的量为3.3mol,则该温度下反应的平衡常数的值为________。
③下列各项数据中能表明该反应已达到化学平衡状态的是_________(填选项字母)。
b.混合气体的密度保持不变
c. △H 保持不变
d.容器的总压强保持不变
(3)将NO2、NO混合气体用碱吸收可得到重要的化工产品NaNO2,已知常温下K(HNO2)=5×10-4,则5mol/L的NaNO2溶液中OH-的物质的量浓度为_________。
(4)消除SO2污染的方法之一是利用电化学法可直接将其转化为硫酸,转化原理如图2所示,则负极上的电极反应式为____________________________,质子的移动方向为____________________(填“自左向右”或“自右向左”)。
29.(10分)
某小组以醋酸为例探究弱酸的性质。
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响。
①设计实验方案如下表,表中c=________ mol·L-1。
| 编号 | 酸的种类 | 酸的浓度/mol·L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
②实验步骤:
a)检查装置(左图)的气密性,添加药品,简述检验装置气密性的方法___________________________;
b)反应开始后,___________________________(填写操作);
c)将所记录的数据转化为曲线图(右图)。
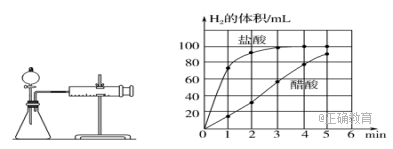
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:____________。
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比)。
设计实验方案,将待测物理量和对应的测定方法填写在下表中。
| 待测物理量 | 测定方法 |
| ①__________ | 量取25.00mL待测醋酸溶液于锥形瓶中,滴加____________指示剂,将0.1000 mol·L-1NaOH标准溶液装入______________中,滴定至终点,记录数据.重复滴定2次. |
| ②__________ | 取待测醋酸溶液于烧杯中,用_________(填仪器名称)测溶液的PH值。 |
30.(14分)
①写出Fe3+的价层电子的电子排布图___________。
②金属羰基配合物中,微粒间作用力有_______(填字母代号)
③羰基铁是一种黄色油状液体.熔点![]() ,沸点
,沸点![]() 。由此推测,固体羰基铁更接近于______(填晶体类型).若用Fe (CO)x表示羰基铁的化学式.x=______
。由此推测,固体羰基铁更接近于______(填晶体类型).若用Fe (CO)x表示羰基铁的化学式.x=______
(3).用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO.
① 1mol COCl2.含有_________mol![]() 键和_________mol
键和_________mol![]() 键.
键.
②与COCl2互为等电子体的一种阴离子为____________,中心原子的杂化方式是_________,离子的空间构型为_________。
③甲胺极易溶于水,除因为它们都是极性分子外,还因为_____________。
(4)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,B位可以是V、Cr、Mn、Fe等。
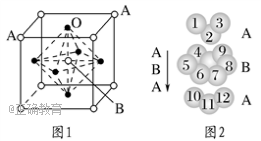
①用A、B、O表示这类特殊晶体的化学式:_________________________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为________。
③下列有关说法正确的是________。
A.镧、锰、氧分别位于周期表f、ds、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
化学答案
选择题
CBCBD ADCBC ADABA CDAAB CCBAA
26.B、GAEHFHACDEH0.1mol·L-11.99×10-5变大Al(OH)3+3H+===Al3++3H2OAl(OH)3+OH-===AlO![]() +2H2O
+2H2O
27、46 ,Al2O3、Fe2O3AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-用洁净的铂丝(铁丝)蘸取溶液1于酒精灯外焰灼烧,透过蓝色钴玻璃看到紫色火焰,即验证溶液1中含有K+BaCl2或Ba(OH)2取最后一次洗涤液少许于试管中,滴加稀硫酸溶液,没有白色沉淀产生,说明沉淀已经洗净。
28.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=―746.5 kJ·molˉ1
N2(g)+2CO2(g) △H=―746.5 kJ·molˉ1
NH30.17mol/(L.min)72.9d10-5SO2 - 2e-+2H2O=SO42-+4H+自左向右
29. 1.0关闭分液漏斗活塞,向外拉动注射器一段距离,停止后注射器恢复到原位,说明气密性良好。每隔1min记录一次生成H2的体积醋酸与镁条反应的速率随时间变化不明显;盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小醋酸溶液的物质的量浓度酚酞碱式滴定管H+的物质的量浓度取适量醋酸溶液于烧杯中,用pH计测定溶液pH
30. C![]() ab分子晶体5 3
ab分子晶体5 3
1 CO32-或NO3-sp2平面三角形甲胺能与水形成分子间氢键ABO3![]() C
C