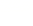 师大附中2018届下学期高三第二次模拟卷
师大附中2018届下学期高三第二次模拟卷
理科综合化学
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 Zn 65
第Ⅰ卷
一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要
求的。
7.化学与生产、生活、科技等密切相关,下列有关解释正确的是
A.用樟脑丸驱除衣柜里的蟑螂,是由于樟脑丸的分解产物能杀灭蟑螂
B.氨气液化以及液氨气化均要吸收大量的热,所以氨气常作制冷剂
C.纯银制品在空气中久置变黑,是因为发生了电化学腐蚀
D.有机磷农药多为磷酸酯或硫代磷酸酯类物质,肥皂水等碱性物质有利其水解而解毒
8.下列各反应对应的离子方程式正确的是
A.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO===CaCO3↓+CO+2H2O
B.向100 mL 0.12 mol·L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH-+2CO2===HCO+BaCO3↓+H2O
C.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO+Ba2++OH-===BaSO4↓+H2O
D.向含0.1 mol NaOH和0.1 mol Na2CO3的溶液中加入1 L 0.4 mol·L-1稀盐酸:OH-+CO+3H+===CO2↑+2H2O
9.下列关于有机化合物的说法正确的是
A.制备聚四氟乙烯的单体属于不饱和烃
B.分子式为C4H10O的醇有4种同分异构体
C.苯乙烯(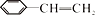 )分子的所有原子不可能在同一平面上
)分子的所有原子不可能在同一平面上
D.异丁烯及甲苯均能使溴水褪色,且褪色原理相同
10.下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明Mg(OH)2沉淀可以转化为Fe(OH)3 | 向2mL1mol/LNaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/LFeCl3 |
| B | 比较氯和碳的非金属性强弱 | 将盐酸滴入碳酸氢钠溶液中 |
| C | 配制100mL1.0mol/LCuSO4溶液 | 将25gCuSO4·5H2O溶于100mL蒸馏水中 |
| D | 验证氧化性:Fe3+>I2 | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,观察下层液体是否变成紫色 |
11.电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH 在5.0~6.0 之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是
A.石墨电极上发生氧化反应
B.通空气的电极反应式为O2+4e-=2O2-
C.通甲烷的电极反应式:CH4+4CO32--8e-=5CO2+2H2O
D.甲烷燃料电池中CO32- 向空气一极移动
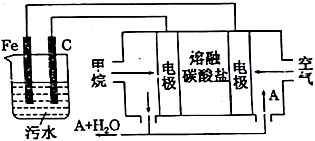
12.已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
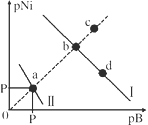
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C.对于曲线I,在b点加热,b点向c点移动
D.P为3.5且对应的阴离子是CO32-
13.X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A.Y的最简单氢化物的热稳定性比Z的强
B.在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C.离子半径:X
D.含W的盐溶液可能呈碱性
26.纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
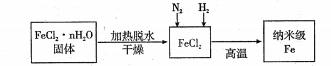
(1)纳米级Fe和稀盐酸反应的离子方程式为__________________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为_________________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
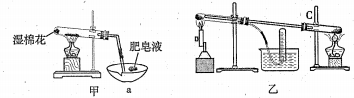
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是_______________________________。
(5)甲装置中仪器a的名称为________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字措述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
27.聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C 及SiO2)为原料制备的流程如下:
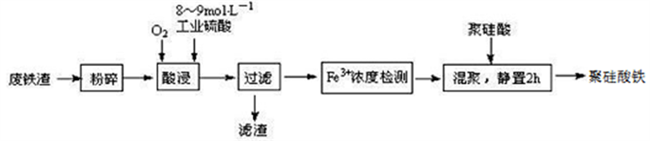
已知:在一定温度下酸浸时Fe3+在pH=2 开始沉淀,pH=3.7 沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
| 温度℃ | 40 | 60 | 80 | 100 | 120 |
| 铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
28.“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
- 已知: ①NO2+COCO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) 2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。 - 在体积可变的恒压(p总)密闭容器中充入1molCO2与足量的碳,让其发生反应: C(s)+ CO2(g) 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。

①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。 - 直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
35.【选修3--物质的结构与性质】 金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
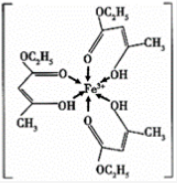
①此配合物中,铁离子价电子排布图为____________________________;
②此配离子中碳原子的杂化轨道类型为___________________;
③此配离子中含有的化学键为_______________。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为________,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是___________。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。
(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
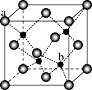
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
36.【选修5--有机化学基础】
有机物M的合成路线如下图所示:
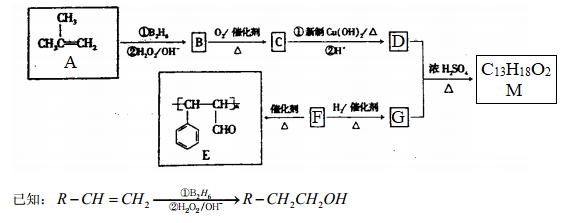
请回答下列问题:
(1)有机物A的系统命名为___________。
(2)F→E的反应类型为_________;B中所含官能团的名称为___________。
(3)M的结构简式为___________。
(4)C与新制Cu(OH)2悬浊液反应的化学方程式为______________________________。
(5)F有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有_____种。
(6)参照M的合成路线,设计一条由丙烯和乙醇为起始原料制备丙酸乙酯的合成路线(无机试剂任选)___________________。
化学答案
一、选择题
7.【答案】D
【解析】A,用樟脑丸驱除衣柜里的蟑螂,是由于樟脑丸的主要成分萘酚具有强烈的挥发性,挥发产生的气体能杀灭蟑螂,A项错误;B,氨气液化时放出大量的热,B项错误;C项,纯银制品在空气中久置变黑,是因为发生了化学腐蚀,C项错误;D,有机磷农药多为磷酸酯或硫代磷酸酯类物质,肥皂水的主要成分为高级脂肪酸盐,由于高级脂肪酸根的水解,肥皂水呈碱性,酯类物质能在碱性条件下发生水解而解毒,D项正确;答案选D。
8.【答案】A
【解析】向Ca(OH)2溶液中加入过量的NaHCO3溶液,反应的化学反应方程式为Ca(OH)2+2NaHCO3===CaCO3↓+Na2CO3+2H2O,对应的离子方程式为Ca2++2OH-+2HCO===CaCO3↓+CO+2H2O,A正确;向100 mL0.12 mol·L-1的Ba(OH)2溶液中通入0.02 mol CO2,反应的化学方程式为3Ba(OH)2+5CO2===BaCO3↓+2Ba(HCO3)2+H2O,对应的离子方程式为Ba2++6OH-+5CO2===4HCO+BaCO3↓+H2O,B错误;硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7,反应的化学方程式为2NaHSO4+Ba(OH)2===Na2SO4+BaSO4↓+2H2O,对应的离子方程式为2H++SO+Ba2++2OH-===BaSO4↓+2H2O,C错误;向含0.1 mol NaOH和0.1 mol Na2CO3的溶液中加入1 L 0.4 mol·L-1稀盐酸,依次发生的反应为NaOH+HCl===NaCl+H2O、Na2CO3+HCl===NaHCO3+NaCl和NaHCO3+HCl===NaCl+CO2↑+H2O,对应的离子方程式依次为OH-+H+===H2O、CO+H+===HCO和HCO+H+===CO2↑+H2O,在题设条件下,总的离子方程式为OH-+CO+3H+===CO2↑+2H2O,D不符合“各反应对应的离子方程式”要求,即方程式之间无联系,不可以加和,D错误。
9.【答案】B
【解析】A,聚四氟乙烯的结构简式为 ,其单体为CF2=CF2,CF2=CF2属于氟代烃,A项错误;B,分子式为C4H10O的醇的同分异构体有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2CHCH2OH、
,其单体为CF2=CF2,CF2=CF2属于氟代烃,A项错误;B,分子式为C4H10O的醇的同分异构体有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2CHCH2OH、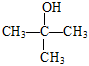 ,共4种,B项正确;C,苯乙烯由苯基和乙烯基通过碳碳单键相连,苯基中与苯环碳原子直接相连的原子共平面(联想苯的结构),乙烯基中与碳碳双键直接相连的原子共平面(联想乙烯的结构),由于单键可以旋转,苯基的平面与乙烯基的平面可能共平面,苯乙烯分子中所有原子可能在同一平面上,C项错误;D,异丁烯使溴水褪色是异丁烯与溴水发生了加成反应,甲苯使溴水褪色是甲苯将溴从溴水中萃取出来,褪色原理不同,D项错误;答案选B。
,共4种,B项正确;C,苯乙烯由苯基和乙烯基通过碳碳单键相连,苯基中与苯环碳原子直接相连的原子共平面(联想苯的结构),乙烯基中与碳碳双键直接相连的原子共平面(联想乙烯的结构),由于单键可以旋转,苯基的平面与乙烯基的平面可能共平面,苯乙烯分子中所有原子可能在同一平面上,C项错误;D,异丁烯使溴水褪色是异丁烯与溴水发生了加成反应,甲苯使溴水褪色是甲苯将溴从溴水中萃取出来,褪色原理不同,D项错误;答案选B。
10.【答案】D
【解析】A、向2mL1mol/LNaOH溶液中先加3滴1mol/L MgCl2溶液,产生白色沉淀,由于NaOH过量,再加入FeCl3时,FeCl3直接与NaOH反应,不能证明沉淀的转化,故A错误;B、将盐酸滴入碳酸氢钠溶液中,产生气泡,证明盐酸酸性强于碳酸,而比较元素的非金属性强弱,要通过比较元素最高价氧化物的水化物的酸性强弱来进行判断,若要比较Cl和C的非金属性强弱,则应比较HClO4与H2CO3的酸性强弱,故B错误;C、将25gCuSO4·5H2O溶于100mL蒸馏水中,溶质CuSO4的物质的量为1mol,而溶液的体积不是100mL,所配溶液的浓度不是1mol/L,故C错误;D、将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层液体变成紫色,则证明产生了I2,说明Fe3+将I-氧化为I2,氧化性Fe3+>I2,故D正确。故选D。
11.【答案】C
【解析】分析装置图可知,右侧为燃料电池装置,其中甲烷为负极燃料,空气为正极燃料;左侧污水处理装置为电解池,Fe接电池正极,则Fe为阳极,石墨为阴极。A、石墨为阴极,阴极得电子,发生还原反应,故A错误;B、电池是以熔融碳酸盐为电解质,空气为正极燃料,电极反应为:O2+2CO2+4e−=2CO32−,故B错误;C、甲烷为负极燃料,电极反应是CH4+4CO32−−8e−=5CO2+2H2O,故C正确;D、电池中阴离子向负极移动,则电池中CO32−向甲烷一极移动,故D错误。故选C。
12.【答案】C
【解析】A,常温下Ksp(NiS)<Ksp(NiCO3),NiS、NiCO3属于同种类型,常温下NiCO3的溶解度大于NiS,A项正确;B,Ksp(NiS)<Ksp(NiCO3),则曲线I代表NiS,曲线II代表NiCO3,在d点溶液中存在溶解平衡NiS(s) Ni2+(aq)+S2-(aq),加入Na2S,S2-浓度增大,平衡逆向移动,Ni2+减小,d点向b点移动,B项正确;C,对曲线I在b点加热,NiS的溶解度增大,Ni2+、S2-浓度增大,b点向a点方向移动,C项错误;D,曲线II代表NiCO3, a点c(Ni2+)=c(CO32-),Ksp(NiCO3)= c(Ni2+)·c(CO32-)=1×10-7,c(Ni2+)=c(CO32-)=1×10-3.5,pNi=pB=3.5且对应的阴离子为CO32-,D项正确;答案选C。
13.【答案】D
【解析】Y的单质经常作为保护气,Y为N元素;由Z、W形成的一种化合物可与X、W形成的化合物反应生成淡黄色固体,此反应为SO2+2H2S=3S+2H2O,X、Y、Z、W的原子序数依次增大,X为H元素,Z为O元素,W为S元素。A,非金属性:Y(N)<Z(O),最简单氢化物的热稳定性:NH3<H2O,A项错误;B,W为S,S处于第三周期,第三周期元素中最高价氧化物对应水化物酸性最强的是HClO4,B项错误;C,根据“层多径大,序大径小”,离子半径:X<Z<Y<W,C项错误;D,含S的盐溶液如Na2S、Na2SO3等溶液呈碱性,Na2SO4等溶液呈中性,NaHSO3溶液等呈酸性,D项正确;答案选D。
26.【答案】(1) Fe+2H+=Fe2+ + H2 ↑ (2) 在干燥的HC1气流中加热 (3) FeCl2+H2 Fe+2HCl (4) Fe+H2O(g)
Fe+2HCl (4) Fe+H2O(g) FeO+H2 (5) 蒸发皿 (6) 加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+ (7) 67.4%
FeO+H2 (5) 蒸发皿 (6) 加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+ (7) 67.4%
【解析】(1)纳米级Fe和稀盐酸反应生成FeCl2和H2,离子方程式为Fe+2H+=Fe2+ + H2 ↑;
(2)FeCl2·nH2O固体加热脱水时,易发生水解,水解方程式为FeCl2+2H2O⇌ Fe(OH)2+2HCl,为防止FeCl2水解,在加热脱水时,通常通入干燥的HCl气体,HCl能抑制FeCl2的水解,且通入的HCl气体可带走水蒸气,利于固体脱水。故答案为:在干燥的HC1气流中加热;
(3)根据流程可知,FeCl2·nH2O固体加入脱水得到FeCl2,然后N2、H2与FeCl2在高温条件下反应得到纳米级Fe,反应方程式为FeCl2+H2 Fe+2HCl。
Fe+2HCl。
(4)根据已知“纳米级Fe粉与水蒸气反应,温度低于570℃时生成FeO”,甲装置用酒精灯加热,反应温度较低,产物为FeO。Fe失电子,水中H得电子,生成氢气,则反应方程式为Fe+H2O(g) FeO+H2;
FeO+H2;
(5)仪器a为蒸发皿;
(6)加入KSCN溶液,溶液没有出现红色,说明溶液中没有Fe3+,可能是因为纳米级Fe粉与水蒸气反应的过程中Fe过量,Fe没有反应完;将反应后的固体,加入少量的盐酸,也可能发生反应Fe+2 Fe3+=3Fe2+,所以看不到血红色。
故答案为:加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+;
(7)用乙装置反应,反应温度高于570℃,则Fe粉与水蒸气反应的固体产物为Fe3O4。反应后所得固体的质量为6.88g,其中氧原子的质量为m(O)=6.88g-5.60g=1.28g,则n(O)=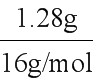 =0.08mol。由关系式1 Fe3O4~4 O,可得n(Fe3O4)=0.02mol。所以固体物质中氧化物的质量分数=
=0.08mol。由关系式1 Fe3O4~4 O,可得n(Fe3O4)=0.02mol。所以固体物质中氧化物的质量分数= =
=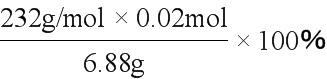 ≈67.4%
≈67.4%
27.【答案】(1) 增大接触面积,同时增大浸取时的反应速率和提高铁浸取率
(2) ①4Fe3O4+O2+36H+=12Fe3++18H2O ②小于2 pH≥2时将有部分Fe3+沉淀损失
③温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低
(3) Fe2(SO4)3和H2SO4 - 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
【解析】(1)废铁渣进行“粉碎”可以增大废铁渣与反应物的接触面积,增大浸取时的反应速率和提高铁浸取率;(2)①酸浸过程中Fe3O4被氧气完全氧化为Fe3+,反应离子方程式是4Fe3O4+O2+36H+=12Fe3++18H2O;②Fe3+在pH=2 开始沉淀,硫酸酸浸时要保证Fe3+不沉淀,所以要控制PH小于2;③升高温度,Fe3+水解平衡正向移动,生成氢氧化铁,所以温度超过100℃时,铁浸取率反而减小;(3)废铁渣中只有Fe3O4与氧气、硫酸反应生成了Fe2(SO4)3和水,所以滤液的成分是Fe2(SO4)3和H2SO4;(4)在酸性条件下, Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
28.【答案】(1) 2NO(g) +2CO(g) N2(g) +2CO2(g) △H=-759.8 kJ/mol 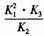
(2) ① > 正向 不 ②25% ③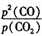 23.04p总
23.04p总
(3) ① c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) ②因为亚硫酸氢根离子存在电离平衡HSO3-H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使平衡正向移动,氢离子浓度增大,pH减小
【解析】(1)由已知,反应①的△H=(812+1076-1490-632)kJ/mol=-234kJ/mol,根据盖斯定律,①×2+③-②得:2NO2(g)+2CO(g) N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K=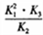 。
。
(2)①该反应正向为气体分子数减小反应,恒温恒压时充入稀有气体,对该反应来说相当于减压,v(正)>v(逆),平衡正向移动。
②设CO2的转化率为α,由已知列三段式得:
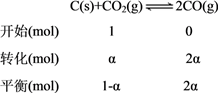
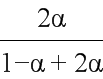 ×100%=40%,解得α=25%。
×100%=40%,解得α=25%。
③用平衡浓度表示该反应化学平衡常数表达式为K=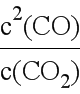 ,所以若用平衡分压代替平衡浓度表示平衡常数的表达式为Kp=
,所以若用平衡分压代替平衡浓度表示平衡常数的表达式为Kp=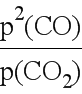 ;由图可得,925℃时CO体积分数为96%,分压为96%×p总,CO2体积分数为4%,分压为4%×p总,所以Kp=
;由图可得,925℃时CO体积分数为96%,分压为96%×p总,CO2体积分数为4%,分压为4%×p总,所以Kp=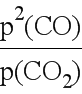 =
=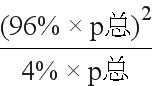 =23.04p总。
=23.04p总。
(3)①由图可得,pH=8时溶液中溶质主要为Na2SO3和NaHSO3,c(SO32-)>c(HSO3-),溶液中的主要离子为:Na+、SO32-、HSO3-,次要离子为OH-、H+,所以各离子浓度由大到小的顺序是:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)。②NaHSO3溶液中HSO3-存在电离平衡HSO3-H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,所以pH降低。
35.【答案】(1) ①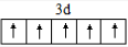 ② sp2、sp3 ③ C D E G H
② sp2、sp3 ③ C D E G H
(2) 平面三角形 O>N>Co>K
(3) CrO2 (4) CH4(SiH4)、NH4+ - 4
 (或
(或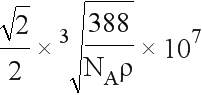 )
)
【解析】试题分析:本题考查物质结构与性质,主要考查价电子排布图的书写,电负性的比较,杂化方式和VSEPR模型的判断,化学键的类型,等电子体的书写,配位数的确定,晶体的计算。
(1)①铁的原子序数为26,基态铁原子核外电子数为26,根据构造原理,基态铁原子的核外电子排布式为[Ar]3d64s2,则Fe3+的核外电子排布式为[Ar]3d5,Fe3+的价电子排布式为3d5,Fe3+的价电子排布式图为 。
。
②此配离子中-C2H5和-CH3中碳原子为sp3杂化,“C=O”和“C=C”中碳原子为sp2杂化,此配离子中碳原子的杂化类型为sp3杂化、sp2杂化。
③根据配离子的结构知,乙酰乙酸乙酯中碳碳之间存在非极性键,碳氢、碳氧、氧氢之间存在极性键,单键中只有σ键,碳碳双键和碳氧双键中存在σ键和π键,Fe3+与乙酰乙酸乙酯之间存在配位键,此配离子中含有的化学键为极性键、非极性键、配位键、σ键和π键,答案选CDEGH。
(2)NO2-中中心原子N的孤电子对数为1/2×(5+1-2×2)=1,成键电子对数为2,价层电子对数为1+2=3,NO2-的VSEPR模型为平面三角形。元素的非金属性越强电负性越大,元素的金属性越强电负性越小,则四种元素的电负性由大到小的顺序为O>N>Co>K。
(3)V2O5中金属阳离子为V5+,V5+的核外电子排布式为1s22s22p63s23p6,没有未成对电子;CrO2中金属阳离子为Cr4+,Cr4+的核外电子排布式为1s22s22p63s23p63d2,3d上有2个未成对电子;根据“金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好”,适合作录音带磁粉原料的是CrO2。
(4)用替换法,与BH4-互为等电子体的分子为CH4、SiH4,离子为NH4+等。
(5)由晶胞可见b的配位数为4,该晶体的化学式为ZnS,则a的配位数也为4。用“均摊法”,晶胞中含a:8×1/8+6×1/2=4,含b:4,设晶胞的边长为x,则晶胞的体积为x3,1mol晶体的体积为x3/4 NA,1mol晶体的质量为(32+65)g=97g,1mol晶体的体积为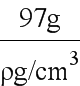 ,x3/4 NA=
,x3/4 NA=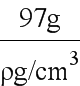 ,解得x=
,解得x=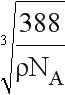 cm。根据晶胞相邻2个b微粒之间的距离为面对角线的一半,相邻2个b微粒之间的距离为
cm。根据晶胞相邻2个b微粒之间的距离为面对角线的一半,相邻2个b微粒之间的距离为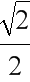 x=
x=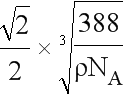 cm=
cm= 107nm。
107nm。
36.【答案】(1) 2-甲基-1-丙烯 (2) 加聚反应 羟基
(3)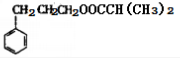
(4) (CH3)2CHCHO+2Cu(OH)2+NaOH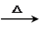 (CH3)2CHCOONa+Cu2O↓+3H2O
(CH3)2CHCOONa+Cu2O↓+3H2O
(5) 4 - CH3CH=CH2
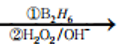 CH3CH2CH2OH
CH3CH2CH2OH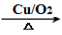 CH3CH2CHO
CH3CH2CHO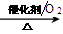 CH3CH2COOH
CH3CH2COOH CH3CH2COOCH2CH3
CH3CH2COOCH2CH3
【解析】试题分析:由合成路线及题中信息可知,A反应后得到B,则B为(CH3)2CHCH2OH;B氧化为C、C经氧化和酸化转化为D,则C为(CH3)2CHCHO、D为(CH3)2CHCOOH;F可以加聚为E,则F为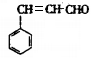 ;E经催化加氢得到G,结合M的分子式可知G为
;E经催化加氢得到G,结合M的分子式可知G为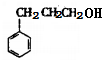 、M为
、M为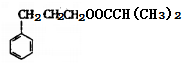 。
。
(1)有机物A的系统命名为2-甲基-1-丙烯。
(2)F→E的反应类型为加聚反应;B中所含官能团的名称为羟基。
(3)M的结构简式为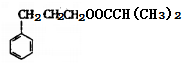 。
。
(4)C与新制Cu(OH)2悬浊液反应的化学方程式为(CH3)2CHCHO+2Cu(OH)2+NaOH (CH3)2CHCOONa+Cu2O↓+3H2O。
(CH3)2CHCOONa+Cu2O↓+3H2O。
(5)F 有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有
有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有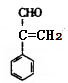 、
、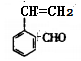 、
、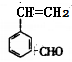 、
、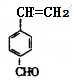 等4种。
等4种。
(6)参照M的合成路线,由丙烯和乙醇为起始原料制备丙酸乙酯,可以先由丙烯合成1-丙醇,然后把1-丙醇氧化为丙醛,接着把丙醛氧化为丙酸,最后丙酸与乙醇发生酯化反应合成丙酸乙酯。合成路线如下:CH3CH=CH2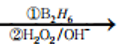 CH3CH2CH2OH
CH3CH2CH2OH CH3CH2CHO
CH3CH2CHO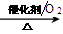 CH3CH2COOH
CH3CH2COOH CH3CH2COOCH2CH3。
CH3CH2COOCH2CH3。
欢迎访问“”——

![]() 师大附中2018届下学期高三第二次模拟卷
师大附中2018届下学期高三第二次模拟卷![]() )分子的所有原子不可能在同一平面上
)分子的所有原子不可能在同一平面上









 ,共4种,B项正确;C,苯乙烯由苯基和乙烯基通过碳碳单键相连,苯基中与苯环碳原子直接相连的原子共平面(联想苯的结构),乙烯基中与碳碳双键直接相连的原子共平面(联想乙烯的结构),由于单键可以旋转,苯基的平面与乙烯基的平面可能共平面,苯乙烯分子中所有原子可能在同一平面上,C项错误;D,异丁烯使溴水褪色是异丁烯与溴水发生了加成反应,甲苯使溴水褪色是甲苯将溴从溴水中萃取出来,褪色原理不同,D项错误;答案选B。
,共4种,B项正确;C,苯乙烯由苯基和乙烯基通过碳碳单键相连,苯基中与苯环碳原子直接相连的原子共平面(联想苯的结构),乙烯基中与碳碳双键直接相连的原子共平面(联想乙烯的结构),由于单键可以旋转,苯基的平面与乙烯基的平面可能共平面,苯乙烯分子中所有原子可能在同一平面上,C项错误;D,异丁烯使溴水褪色是异丁烯与溴水发生了加成反应,甲苯使溴水褪色是甲苯将溴从溴水中萃取出来,褪色原理不同,D项错误;答案选B。
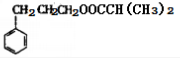
 ;E经催化加氢得到G,结合M的分子式可知G为
;E经催化加氢得到G,结合M的分子式可知G为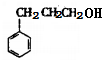 、M为
、M为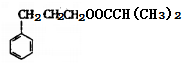 。
。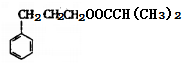 。
。![]() (CH3)2CHCOONa+Cu2O↓+3H2O。
(CH3)2CHCOONa+Cu2O↓+3H2O。 有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有
有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有 、
、 、
、 、
、 等4种。
等4种。![]() CH3CH2CH2OH
CH3CH2CH2OH![]() CH3CH2CHO
CH3CH2CHO![]() CH3CH2COOH
CH3CH2COOH![]() CH3CH2COOCH2CH3。
CH3CH2COOCH2CH3。