
湖南省醴陵二中、醴陵四中2016-2017学年高二下学期期中联考化学试卷
03月05日
![]() 漳州市2018届高三下学期第三次调研测试(5月)
漳州市2018届高三下学期第三次调研测试(5月)
理综化学
7、化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.高铁车用大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点
B.油脂在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
C.丝绸的主要成分是天然纤维素,属于高分子化合物
D.《本草纲目》中“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”这里的“石碱”是指KOH
8、设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A.乙烯和环丁烷(C4H8)的混合气体共28 g充分燃烧消耗3NA个O2
B.0.1mol-NH2 (氨基)中所含有的电子数为NA
C.1L0.1mol·L-1Na2S溶液中,S2-、HS-和H2S的微粒数之和为0.1NA
D.在K37ClO3+ 6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212 g氯气生成,则反应中电子转移的数目为5NA
9、TPE (四苯基乙烯)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如右图,下列关于TPE的说法正确的是
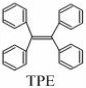
A TPE的分子式为C26H22 B.TPE能发生加成反应,不能发生取代反应
C.TPE与化合物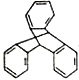 互为同分异构体 D.TPE的一氯代物有3种
互为同分异构体 D.TPE的一氯代物有3种
10、下列实验操作能达到实验目的的是
| 实验目的 | 实验操作 | |
| A | 除去MgCl2溶液中的少量FeCl3 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后,过滤 |
| B | 检验溶液中是否含有SO42- | 取少量溶液于试管中,先加入BaCl2溶液,再滴加稀盐酸若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| C | 比较HCl和CH3COOH的酸性强弱 | 用pH试纸测定浓度均为0.1mol·L-1的NaClO溶液和CH3COONa溶液的pH |
| D | 验证H2O2的氧化性比Fe3+强 | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 |
11、某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是
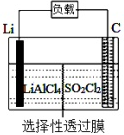
B.电池工作时电子流向:锂电极→导线→负载→碳棒
C.电池工作时,外电路流过0.2 mol电子,标准状况下生成4.48 L气体
D.电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
12、短周期元素W、X、Y、Z的原子序数依次增大。m、P、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如下图所示。下列说法正确的是
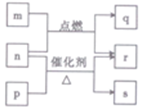
C.Z的氢化物比Y的氢化物稳定 D.Z的含氧酸是一种强酸
13、25℃时,将浓度均为0.1mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,且保持 Va+Vb=100mL,Va、Vb 与混合液的 pH 的关系如图所示.下列说法正确的是
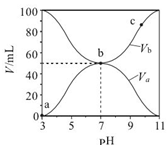
C.a→c过程中水的电离程度始终增大
D.b点时,c(B+)=c(A-)
26、(14分)三氯氧磷(POCl3)可用作有机合成的氯化剂和催化剂。
已知:①KSCN+AgNO3=AgSCN↓+KNO3;
②Ksp(AgCl) >Ksp(AgSCN);
③磷酸银可溶于硝酸;
④PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
| PCl3 | -111.8 | 74.2 | 137.5 | 均为无色液体,遇水均剧烈水解,生成含氧酸和氯化氢,两者互溶。 |
| POCl3 | 2.0 | 105.3 | 153.5 |
实验室制取POCl3并测定产品纯度的实验过程如下:
Ⅰ.制备POCl3可用氧气氧化液态PCl3的方法。实验装置(加热及夹持装置省略)如下:
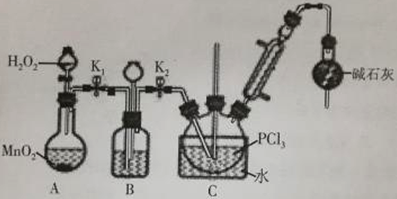
(1)装置C中盛装PCl3的仪器名称为_______________________;氧气氧化PCl3的化学方程式为_______________________________。
(2)仪器组装完成后,检查装置B气密性的方法是_______________________________。
(3)装置B的作用有________________________________(回答两点)。
(4)装置C的反应温度控制在60-65℃之间,原因是____________________________________。
Ⅱ.测定产品中POCl3纯度的实验步骤:
①实验Ⅰ结束后,待反应器中液体冷却到室温,准确称取1.3300 g的POCl3粗产品(杂质不含氯元素),置于盛有50.00mL蒸馏水的烧杯中摇动至完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入30.00mL0.1200mol·L-1AgNO3标准溶液;
③加入少量硝基苯,用力摇动,静置;
④加入指示剂,用0.1000 mol·L-1KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去12.00mLKSCN溶液。
(5)滴定过程中选择的指示剂为___________溶液。
(6)步骤③的目的是___________________________________________________。
(7)测得产品中POCl3的纯度为__________%。
27、(14分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),制备黄血盐的一种工艺如下:
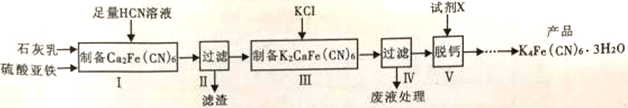
回答下列问题:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为__________________。
(2)步骤Ⅱ中滤渣的主要成分是_______________,步骤Ⅴ所用的试剂X可以是________________。
(3)步骤Ⅲ反应的化学方程式为_______________________________________。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。25℃时,Ka(HCN) =6.25×10-10。
①HCN的电子式为__________________。
②25℃时,反应CN-+H2OHCN+OH-的平衡常数K=_____________________。
③含CN-废水的处理方法之一是:pH控制在11左右,用氯气将废水中CN-氧化成CO2和N2,该反应的离子方程式为_____________________________________。
(5)近日,一条“盐里面加进了亚铁氰化钾”危害身体健康的信息在网上流传。已知K4Fe(CN)6![]() 4KCN+FeC2+N2↑,氧化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,-名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
4KCN+FeC2+N2↑,氧化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,-名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
28、(15分)氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O24N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H =-1891.5kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H =+180.5kJ•mol-1
③H2O(1)=H2O(g) △H =+44.0kJ•mol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为_________________________________。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如右图所示。
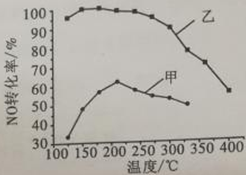
①工业上选择催化剂乙的原因是_________________。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是_______________________。
Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:
CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJ•mol-1
(3)在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据,计算0-4min内v(NO2)=____________,该温度下的平衡常数K=________________。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率a(NO2)如下图,则下列叙述正确的是
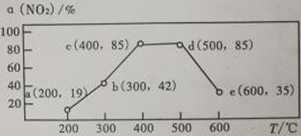
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
(5)清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)的NOx电化学还原技术,为大气污染物治理开拓了新颖的思路。SOEC反应器的工作原理如图所示。电源的a 是________极。写出阴极的电极反应式:__________________________________。
35、[化学——选修3:物质结构与性质] (15分)
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为________________;用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因是_______________________________;
(2)已知:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是__________(填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是__________(填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3]![]() 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
①分解产物中属于非极性分子的是_________(填选项字母)。
A.NH3 B.CO2 C.N2 D.H2O
②反应物中的CO32-的空间构型为_____________。分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为______________。
),则CO32-中的大π键应表示为______________。
③HN3(氢叠氮酸)常用于引爆剂,其分子的结构式可表示为:![]() 。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
(4)UO2的晶胞结构如图所示:
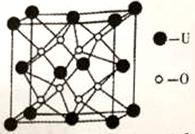
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的___________空隙中。(填“立方体”、“四面体”、“八面体”)
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为___________g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
36、[化学——选修5:有机化学基础](15分)
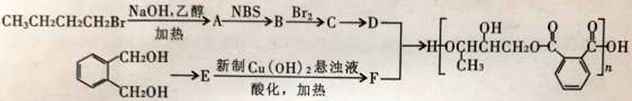
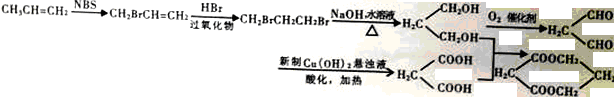
醇酸树脂固化成膜后具有良好的耐磨性和绝缘性,下面是一种成膜性良好的醇酸树脂的合成路线,如下图所示:
已知: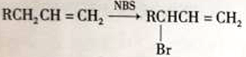 RCH=CH2
RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
(1)A的化学名称为________________,E中官能团的名称是__________________。
(2)B的结构简式为_______________,C制备D的反应条件是_____________,制备E的反应类型是_______________________。
(3)下列说法正确的是_________。
A.D是甘油的同系物
B.C是不溶于水的油状液体
C.F不能与新制氢氧化铜悬浊液反应
D.只用硝酸银溶液,就可以检出CH3CH2CH2CH2Br中是否含有溴原子
(4)写出D、F在一定条件下反应生成醇酸树脂的化学方程式________________________。
(5)芳香族化合物X是![]() 的同分异构体,X遇FeCl3溶液显紫色,可发生消去反应,其核微共振氢谱显示有6 种不同化学环境的氢,峰面积比为1∶1∶1∶2∶2∶3。写出符合要求的X的结构简式________________。
的同分异构体,X遇FeCl3溶液显紫色,可发生消去反应,其核微共振氢谱显示有6 种不同化学环境的氢,峰面积比为1∶1∶1∶2∶2∶3。写出符合要求的X的结构简式________________。
(6)请参考本题信息写出以CH3CH=CH2为原料制备化合物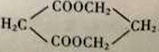 的合成线路流程图(无机试剂任选)。
的合成线路流程图(无机试剂任选)。

7-13 ABDACBD
26、(14分)
27、(14分)
不能达到氰化钾的半数致死量。(2分)
28、(15分)
35、[化学一选修3:物质结构与性质] (15分)
36、[化学——选修5:有机化学基础] (15分)
(3分,其他合理答案也可)
欢迎访问“”——